Em primeiro lugar, o mundo maravilhoso da Internet nos poupa dessa tarefa de equlibrar pratos com sites abençoados como esse. Mesmo assim, decidi trazer o resultado de uma consulta para comentar com vocês. Nem todas as informações disponíveis podem parecer intuitivas à primeira vista, e como eu sou das humanas, preciso de tudo mastigadinho. Pense no balanceamento como um sistema linear, creio que isso pode ajudar. Ao passo que queremos isolar variáveis na matemática, como amiúde fazemos em várias ocasiões, na química queremos que os dois lados da fórmula, os reagentes e os produtos, tenham o mesmo número de átomos. Uma balança, pense sempre em uma balança, ao fazer esse processo. ⚖️
O site propõe dois métodos de balanceamento, e farei rápidos comentários (em azul) sobre possíveis dificuldades semelhantes às minhas:
| Balanceamento passo a passo usando o método de inspeção |
|---|
| Vamos equilibrar esta equação usando o método de inspeção. Primeiro, definimos todos os coeficientes como 1: 1 C4H10 + 1 O2 = 1 CO2 + 1 H2O Para cada elemento, verificamos se o número de átomos está equilibrado em ambos os lados da equação. C não está equilibrado: 4 átomos em reagentes e 1 átomos em produtos. Para equilibrar C em ambos os lados, nós: Multiplique o coeficiente de CO2 por 4 1 C4H10 + 1 O2 = 4 CO2 + 1 H2O H não está equilibrado: 10 átomos em reagentes e 2 átomos em produtos. Para equilibrar H em ambos os lados, nós: Multiplique o coeficiente de H2O por 5 1 C4H10 + 1 O2 = 4 CO2 + 5 H2O O não está equilibrado: 2 átomos em reagentes e 13 átomos em produtos. Para equilibrar O em ambos os lados, nós: Multiplique o coeficiente de O2 por 13 Multiplique o(s) coeficiente(s) de CO2, H2O, C4H10 por 2 2 C4H10 + 13 O2 = 8 CO2 + 10 H2O Esta parte me confundiu um pouco. De onde saíram esses 13 átomos em produtos? Então… quando multiplicamos CO2 por 4, temos 8 átomos de O. E quando multiplicamos H2O por 5, temos 5 átomos de oxigênio. Tudo isso do lado do produto. Para o reagente ficar com quantia igual de oxigênio, só resta multiplicar o coeficiente por 13.. Para não se confundir, ignore o número subescrito depois de O. C está equilibrado: 8 átomos em reagentes e 8 átomos em produtos. H está equilibrado: 20 átomos em reagentes e 20 átomos em produtos. Todos os átomos estão balanceados e a equação toda está completamente balanceada: 2 C4H10 + 13 O2 = 8 CO2 + 10 H2O |
a C4H10 + b O2 = c CO2 + d H2O
C: a*4 = c*1
H: a*10 = d*2
O: b*2 = c*2+d*1
Atribua a = 1 e resolva a equação linear. 👇👇👇
a=1
C: 4 = c 👉c = 4
H: 10 = 2d 👉d = 5
O: 2b = 4*2 + 5*1 👉2b = 13 👉b = 6,5
Para chegar aos coeficientes inteiros, multiplique todos os resultados por 2. Os átomos não costumam trabalhar com números quebrados.
Por fim, despeço-me com uma demonstração visual de como um balanceamento funciona. Essa representação gráfica dos átomos foi obtida pelo Geogebra, com este material feito pelo brasuca Ricardo de Oliveira Peixoto.

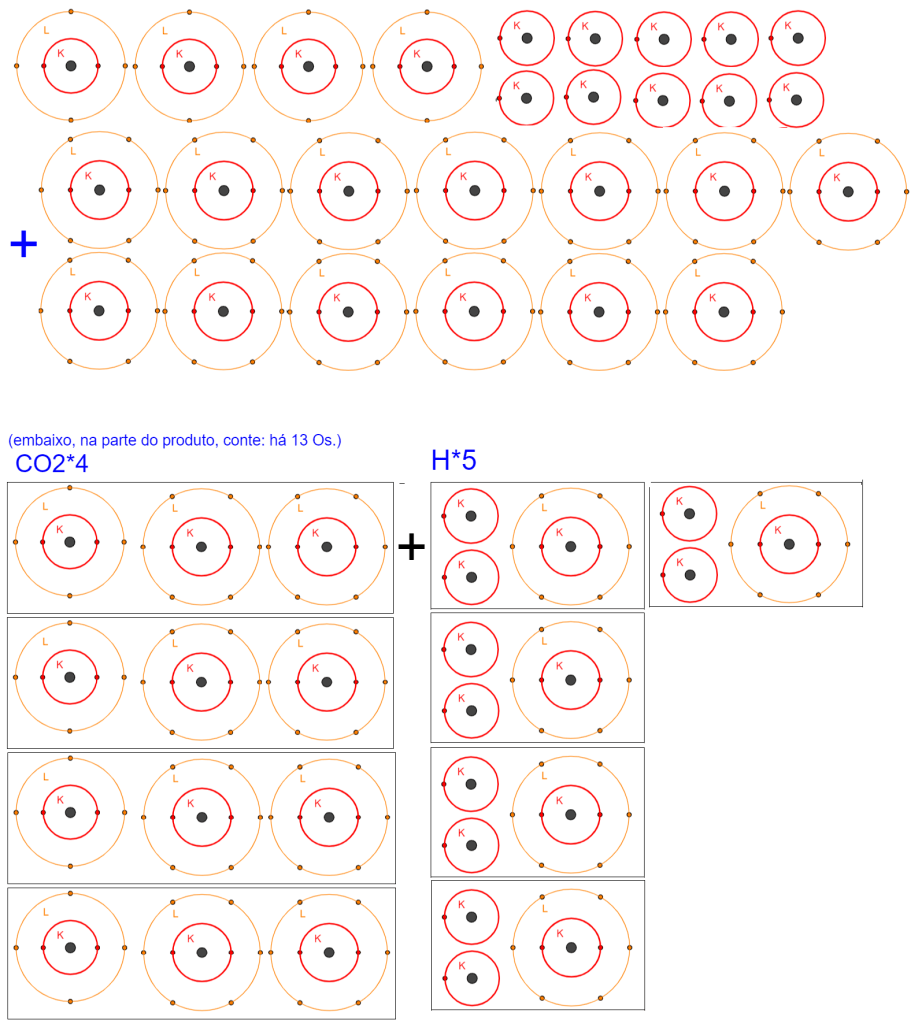
Deixe um comentário